식품의약품안전처가 지난 15일 에임메드가 개발한 인지치료 소프트웨어 ‘솜즈’를 국내 첫 디지털 치료기기(DTx)로 허가했다. 이에 따라 한국에서도 디지털 치료제 사용이 본격화 될 전망이다. 디지털 치료제는 의학적 장애나 질병을 예방·관리·치료하기 위해 환자에게 근거 기반의 치료적 개입을 제공하는 소프트웨어 의료기기이다.
한국보건산업진흥원 ‘주요국 DTx 관련 정책 및 산업 동향’ 리포트에 따르면 글로벌 DTx 시장은 2022년 38억8000만 달러 규모로 추정되며, 연평균 20.5% 성장해 2030년 173억4000만 달러에 달할 것으로 전망된다. 시장이 급속도로 확대되면서 경쟁도 치열해 질 것으로 보인다.
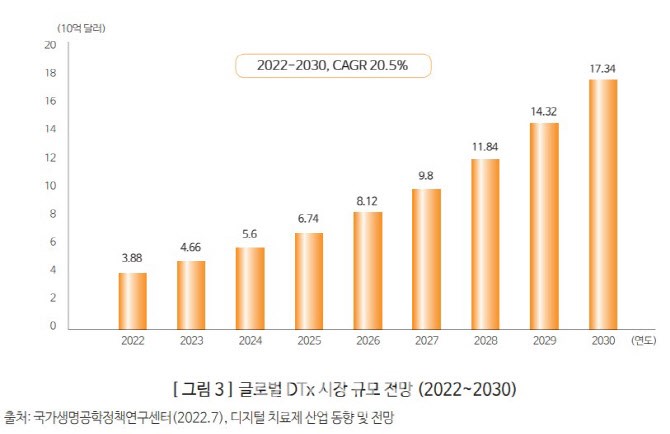
(자료=한국보건산업진흥원)
2010년 미국 식품의약국(FDA)가 승인한 2형 당뇨병 환자 치료를 위한 자기 관리앱 웰독사의 블루스타(BlueStar)를 시작으로 2020년까지 당뇨병, 심부전, 천식, 만성 폐색성 폐질환, 오피오이드 사용장애, 만성 불면증, ADHD(주의 부족·다동증), PTSD(심적 외상 후 스트레스 장애) 질병에 대한 DTx 제품화로 이어졌다. 2022년 3월 말 기준 DTx 개발기업과 제품은 각각 16개, 20개로 집계된다. 16대 기업 중 75%가 비상장기업이고, 2010년 이후 창업한 기업은 75%다.
세계 각국은 DTx 산업을 장려하기 위해 규제 정비를 적극 추진하고 있다. 먼저 미국은 2020년 4월 FDA의 코로나19 응급상황의 정신질환 치료를 위한 디지털 건강 장비에 대한 시행 방침의 지침을 발표해 DTx 도입을 적극적으로 추진하고 있다. 해당 지침은 정신건강 및 정신질환에 대한 저위험의 일반적인 웰니스 제품과 디지털 건강 제품이라는 두 가지 범주에서의 DTx를 인정하고 있다. 이들 제품에 대해 위험 경감을 위한 적절한 조치를 취하면, FDA는 개체 식별 규격, 리스트·등록 요건, 시판 전 신고를 면제해 규제를 완화했다.
특히 디지털 치료제 업계는 보험 급여 필요성을 주장하고 있는데, 미국의 경우 공공의료보장 제도인 메디케어에 의한 공식적인 정책은 존재하지 않고 있다. 단 민간보험 및 고용주가 제공하는 복리후생 프로그램에서는 일부 프로그램 의료기기를 포함하는 경우가 있다. 또한 메디케어 운영 주체인 보건복지부 산한 보건의료재정청(CMS)는 2021년 첨단 의료를 이용한 의료기기를 일부 메디케어에 포함해야 한다고 주장했다.
2022년 2월 CMS는 ‘처방 디지털 행동요법(PDT)’에 새로운 수준Ⅱ의 의료 공통 치료행위 코딩 시스템을 적용하기로 발표했다. 이는 DTx 기업이 개발하는 소프트웨어 기반 치료기기가 메디케이드와 민간 보험의 급여 대상이 쉽게 될 수 있는 계기가 됐다. 3가지 종류의 DTx 제품에 대해 FDA 승인을 받고 있는 Pear Therapeutics사는 처방 PDT에 코드 번호를 부요하는 것을 CMS에 요청했고, 코드가 부여되면 향후 DTx 보급이 확대될 전망이다.
독일은 2019년 12월 디지털헬스케어법(DVG)에 의해 DTx(DiGA)를 도입했고, DTx를 공적 의료보험 조합(GKV-SV) 보상 의료서비스 대상에 포함했다. 보험 급여의 경우 DiGA가 치료에 대한 긍정적 효과 입증을 제외한 모든 요구사항을 충족해 등재되면 보험 급여의 대상이 된다.
임시등재와 영구등재로 구분되는데, 임시등재의 경우 보험 급여를 받기 위해 첫해 동안 DiGA 제조사는 해당되는 경우, 공공의무보험(SHI)과 민간보험(PHI), 급여를 자체적으로 설정할 수 있다. 영구등재는 환급 가격은 향후 모든 연도에 대해 공적 의료보험 조합과 협상 및 합의 과정을 거쳐 설정된다.
한국도 국제적 흐름에 맞춰 DTx 분야에 대해 R&D 지원, 제도 개선 및 관련 입법을 꾸준히 추진 중이다. DTx 관련 정부 R&D 투자는 최근 5년(2015~2019년) 동안 총 442억원이고, 연평균 25.3%로 급격히 증가하고 있다. 또한 DTx 제품화 및 상용화를 위해 디지털 진단치료기기 인허가 가이드라인을 마련해 국가 기준을 제시하고 있다.