바이오헬스 신시장 창출전략을 발표한 정부가 이번에는 규제혁신 방안까지 내놓으며 관련 산업 육성에 속도를 내고 있다. 이를 통해 혁신적 의료기기 시장 진입을 가속화하고, 희귀질환 치료제의 경우 품목허가부터 약가협상까지 병행하는 새로운 모델을 구축한다. 이른바 '디지털 헬스케어법' 제정과 함께 첨단 바이오의약품 관련 규제 해소 등 바이오헬스 전방위 분야에서 경쟁력 제고에 나선다.
보건복지부는 2일 한덕수 국무총리가 주재한 제3차 규제혁신전략회의에서 이 같은 내용이 담긴 '바이오헬스 신산업 규제혁신 방안'을 발표했다. 이번 규제혁신 방안은 지난달 28일 발표한 바이오헬스 신시장 창출전략의 일환으로 디지털·바이오헬스 글로벌 중심국가 도약 기반을 마련하고자 범정부 차원에서 마련됐다.
복지부는 국민 생명 보호와 민간 혁신을 유도할 수 있는 ▲혁신적 의료기기 ▲혁신·필수 의약품 ▲디지털 헬스케어 ▲첨단재생의료·첨단바이오의약품 ▲유전자 검사 ▲뇌-기계 인터페이스 ▲인프라 등 7대 핵심분야에 대한 규제혁신을 추진한다.
먼저 혁신적 의료기기의 시장 선진입 체계 마련을 위해 기존 신의료기술 평가유예제도, 통합심사·평가제도에서 한발 더 나아가 적용 대상을 더욱 확대한다. 특히 최근 국내 1호 승인이 이뤄진 '디지털치료기기(DTx, 디지털치료제)'가 국내 시장에서 활용·확산될 수 있도록 건강보험 적용방안을 정립하기로 했다. 혁신·필수 의약품 분야에서는 암·희귀질환 치료제에 대해 품목허가와 급여평가, 약가협상을 동시에 진행하는 시범사업을 진행하고, 비대면 임상시험 가이드라인과 혁신 신약에 대한 적정 보상방안을 마련할 민관협의체를 구성한다.
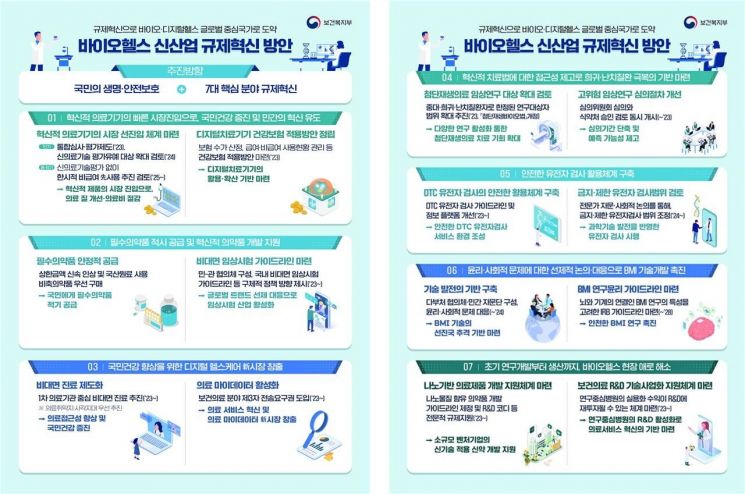
바이오헬스 신산업 규제혁신 방안 인포그래픽.[사진제공=보건복지부]
디지털 헬스케어 분야에서는 의료기관이 안전관리기준을 충족하는 제삼자에게 의료데이터를 직접 전송할 수 있는 법령 마련을 추진하고, 바이오헬스 데이터에 특화된 기관생명윤리심의위원회(IRB) 가이드라인을 마련해 안전한 보건의료데이터 활용 체계를 구축한다. 첨단재생의료·첨단바이오의약품 측면에서는 단기적으로 고위험 임상연구 심의절차를 개선해 기간을 단축하는 한편, 중장기적으로 재생의료시술 도입과 임상연구 대상 질환 확대 등을 검토할 예정이다.
지난해 7월 소비자 직접 시행(DTC) 유전자 검사 인증제 시행에 따라 국내 DTC 유전자 검사가 활성화될 것으로 예상되는 가운데 관련 규제 개선도 추진된다. DTC 유전자 검사 가이드라인을 소비자와 검사기관이 실제 활용할 수 있는 내용으로 개정하고, 검사 정보 플랫폼 기능도 상담·교육이 가능하도록 강화한다. 뇌 신호로 기기를 조작하는 '뇌-기계 인터페이스(BMI)' 분야에서는 특화된 지침 마련과 다부처 협의체·민간 자문단을 구성하는 등 전주기적 기술 개발을 촉진한다. 마지막으로 인프라 면에서는 신기술 적용 의약품 개발지원 체계 마련과 의료기술산학협력단 설치, 첨단의료복합단지 생산품목 및 입주기업 임대 제한 완화를 통한 창업기업 지원 강화 등을 도모한다.
조규홍 보건복지부 장관은 "바이오헬스는 저성장 시대 미래먹거리 산업이자 국민 건강과 국가 안보에서도 중추적 역할을 담당한다"며 "복지부는 바이오헬스 신시장을 창출하고 국민에게 더 나은 보건의료 서비스를 제공할 수 있도록 바이오헬스 분야 규제혁신을 지속해서 추진해나갈 것"이라고 말했다.