딥매쳐 플랫폼과 타사의 AI 신약 플랫폼 기술의 차이점은.
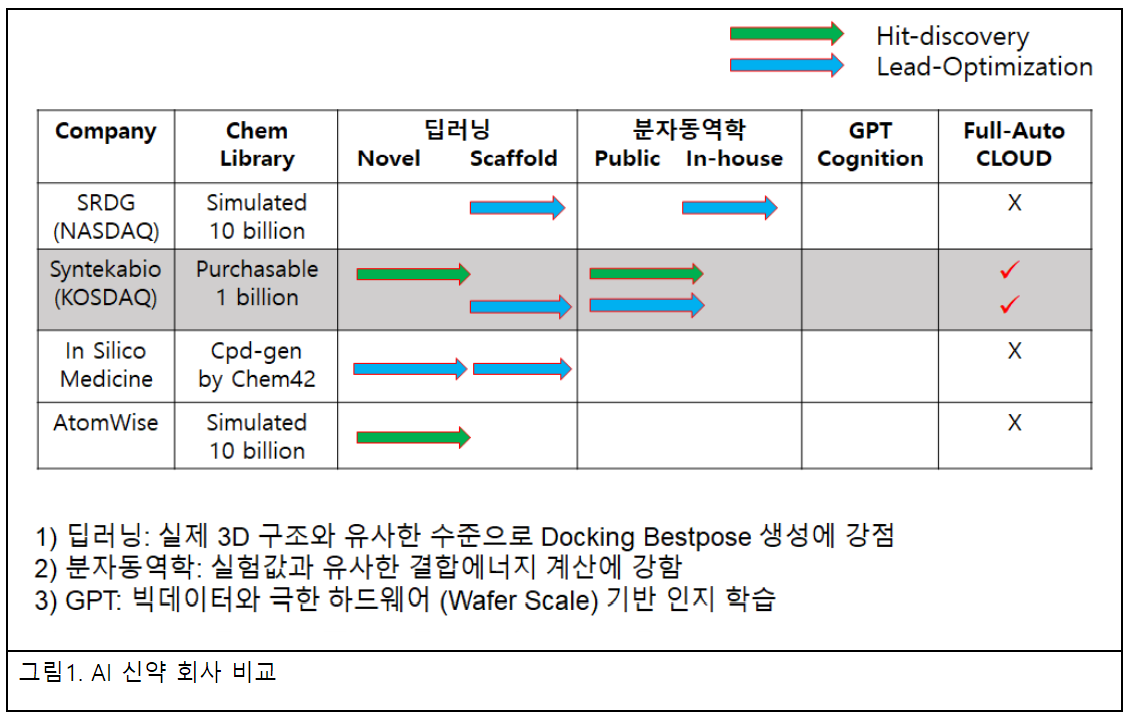
현재까지 AI신약 방법을 명확하게 공개한 AI 신약개발 회사는 슈뢰딩거(Schrodinger), 인실리코 메디슨(Insilico Medicine), 아톰와이즈(Atomwise) 정도를 꼽을 수 있다. 슈뢰딩거는 분자동역학 기반 정밀한 결합력( energy) 계산에 강점을 보이는 ‘FEP+(free energy perturbation)’ 플랫폼을 보유하고 있으며, 이 방식은 신약개발에서 미투(Me-Too) 약물 디자인에 가장 잘 활용되는 기술로 알려졌다.
인실리코 메디슨은 생성-AI 약물 설계 플랫폼(Generative AI drug design platform)이라고 알려진 ‘케미스트리42(Chemistry42)’를 보유하고 있다. 이 플랫폼은 30가지 이상의 생성모델(Generative model)을 병렬적으로 사용해 신규 물질을 생성하고 합성 가능성 및 신규성, 다양성을 고려해 후보물질을 최종 선별한다. 해당 알고리듬의 핵심인 인코더(Encoder)와 디코더(Decoder)는 컴퓨터 사이언스에서 아주 중요한 영역이며, 인실리코 메디슨은 이를 잘 활용하는 것으로 보인다. 특히 케미스트리42 플랫폼으로 자체 합성 대상 물질을 디자인하는 접근 방법은 아주 독창적이다. 로보틱 환경에 의한 자동 실험검증 시스템을 도입한 것 또한 이 회사의 강점이다.
아톰와이즈도 초기부터 활발하게 활동하고 있는 잘 알려진 AI-신약 업체이며, 최근에는 AI 기반으로 더 향상된 성능의 ‘ANPR(AtomNet PoseRanker)’도 선보였다. 다만 슈뢰딩거나 신테카바이오처럼 분자동역학기반 위양성(false positive)을 제거하는 물리기반의 자동화 환경을 갖추지 않아 검증 효율성이 떨어질 수 있다.
신약 후보물질 발굴을 원하는 고객사의 측면에서 보면 한 번에 유효물질 발굴 및 선도물질 최적화가 가능하다는 점에서 슈뢰딩거, 인실리코 메디슨, 아톰와이즈의 서비스는 전통적인 방법과 비교할 때 여전히 혁신적인 방법이다. AI 신약 플랫폼에서 유효물질을 선별한 후 바로 다량의 선도물질 유도체를 만들어 검증 분석을 수행하기 때문이다. 글로벌 제약사들이 고비용에도 해당 회사들의 서비스를 이용하는 이유이기도 하다. 다만 이러한 서비스를 이용하는 비용 규모는 중소형 국내 제약사, 신약개발 연구소 및 대학 등에서는 현실적으로 접근하기 부담스러운 수준이다.
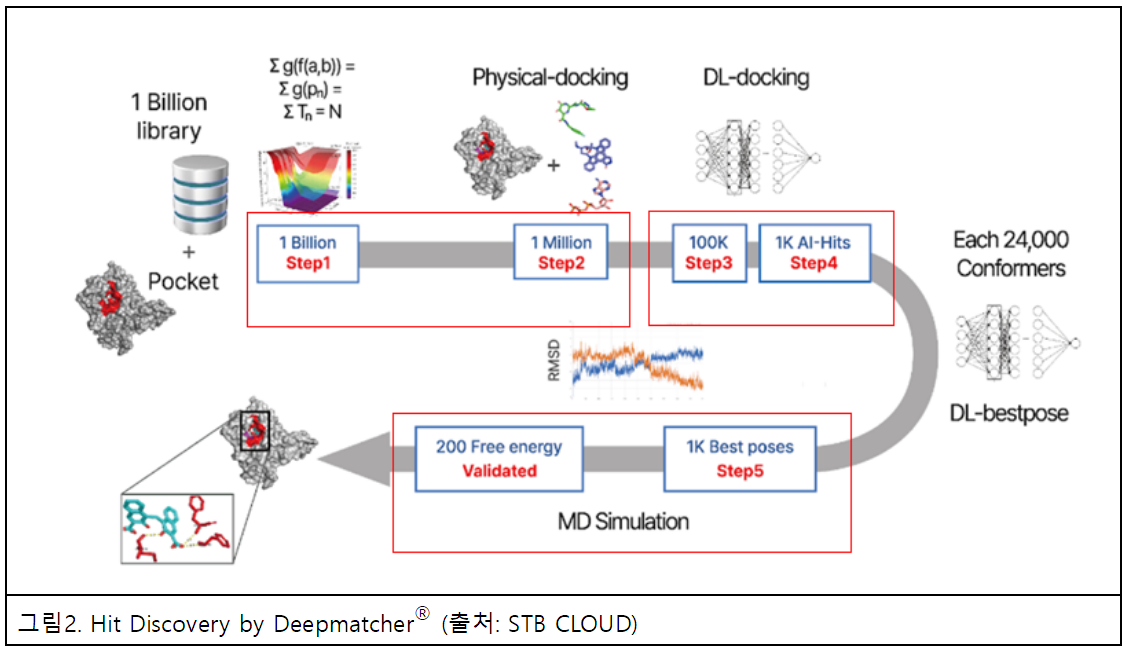
신테카바이오는 2022년 10월 말 공개한 STB CLOUD(에스티비 클라우드)를 통해서 클라우드 기반에서 단 한 번의 클릭(one click)으로 다음과 같은 신약 후보물질 발굴 서비스를 제공한다. 대부분 표적들에 대해 △구입가능한 10억개 화합물 스크리닝 수행 △각각 발굴된 1천 개 단위의 후보 물질에 대한 심층학습을 통해 최적의 포즈(Best pose) 탐색 △물리기반의 동역학 시뮬레이션을 모두 수행 △바인딩 에너지 기반 위양성(false positive)을 제거해 최종적으로 100~200개의 AI-hit 후보물질을 선별한다.
이러한 클라우드 기반 서비스는 고객 정보에 대해 보안이 가능하고, 100% 자동화 환경이기 때문에 전문 지식이 없이도 누구나 빠르게 신약개발 파이프라인을 만드는 데 활용할 수 있다. 또한 구입 가능한 화합물 기반으로 스크리닝을 하므로 최소한의 합성으로 신규 유효물질을 발굴할 수 있어서, 비교적 4~5배 저렴하게 세계 최초 혁신 신약(first-in-class) 화합물 발굴이 가능하다. STB CLOUD를 활용함으로써 글로벌 제약사를 비롯해 국내 제약사 및 국가출연 연구소 등에서도 낮은 가격으로 후보물질 발굴이 가능하다.
 △자료=신테카바이오 제공
△자료=신테카바이오 제공
Hit-발굴 성공률에 기여하는 AI 신약개발의 가장 큰 요소는.
컴퓨터 기반 Hit-발굴을 위해서는 후보물질 검색, 최적포즈 생성, 분자동역학 검증 단계까지 총 세 단계를 필수적으로 거쳐야 한다. AI 및 고급 알고리듬 등은 후보물질 검색 및 최적포즈 생성 단계에 큰 기여를 한다. 후보물질 검색 후 최적포즈를 생성할 수 있어야 정확한 바인딩 에너지를 적용할 수 있고, 그 이후 산출된 후보물질의 랭킹 순서에 따라 실험 검증을 진행한다.
실험 검증 시 100, 1000, 5000개 등 검증량을 어느 수준으로 정해 실험을 하는지에 따라 비용이 기하급수적으로 증가하기 때문에 실험 비용을 절감하기 위해서 위양성(false positive)를 줄이는 것이 중요하다. Hit 물질 발굴 두 번째 단계에서 선별된 최적포즈(best pose)에 대한 3번째 단계인 분자동역학을 적용하면 구조가 가장 실험값에 근접한 최적포즈가 생성된다. 그 이후 바인딩 에너지로 랭킹만 산출해도 위양성이 많이 감소한다는 결과가 여러 논문에서 보고됐다.
최상급의 AI 및 고급 알고리듬에 분자동역학 검증 단계를 추가하면 후보물질 발굴 능력이 2배 이상 개선되는 것을 내부 연구에서도 확인했다. 단순히 활성 물질만 찾는 것이 아니라 위양성 물질이 제외된 유효성이 우수한 물질 도출이 가능하다는 것이다. 현재 슈뢰딩거, 인실리코 메디슨, 아톰와이즈, 신테카바이오 등 AI 신약개발 기업 중 자동으로 3단계를 모두 운영하는 기관은 신테카바이오와 슈뢰딩거 정도다.
딥매쳐 플랫폼에서 약물 최적화(Lead-Opt)도 가능한지.
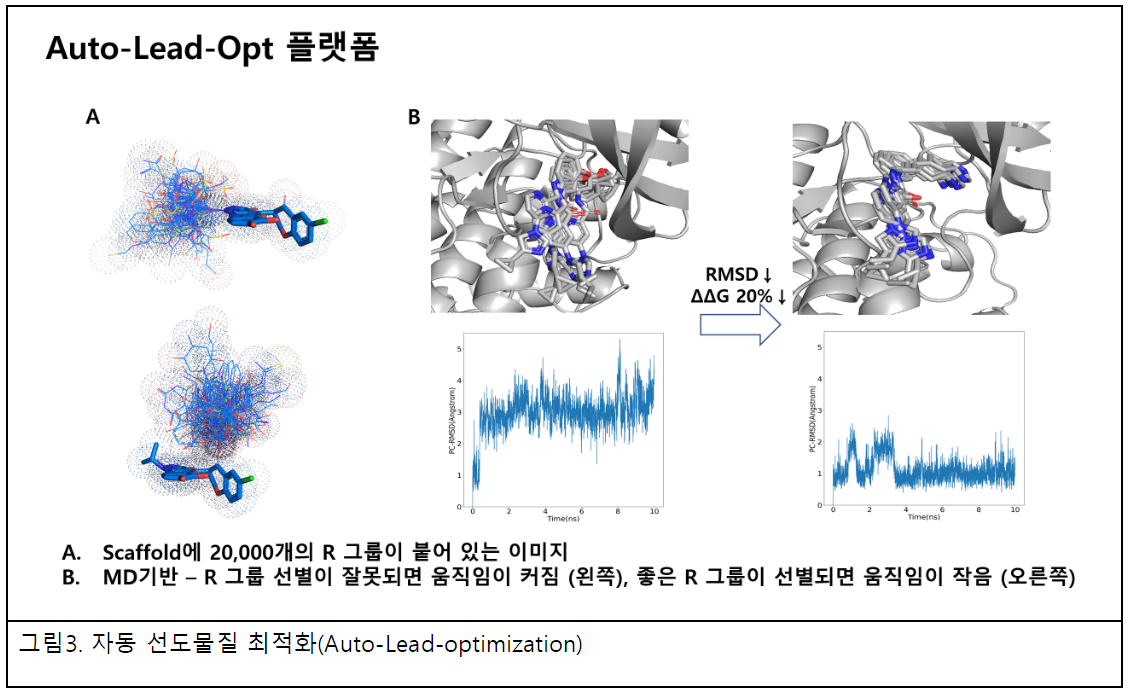
신테카바이오는 자체적으로 개발한 Gap2라는 약물최적화 소프트웨어(CLI: commend line interpreter)를 가지고 있다. 전통적인 방법은 그래픽사용자환경(GUI: Graphical user interface)을 사용하기 때문에 유도체를 만들 때 한 번에 대규모 R-그룹(치환기)을 붙이는 작업이 불가하지만, Gap2는 슈퍼컴 환경에서 이 작업이 가능하다. Gap2 프로그램의 또 다른 특징은 단백질과 약물이 바인딩되는 포켓 안에서 약물핵심골격(scaffold)의 특정 원자에 R-그룹을 바로 붙일 수 있다는 것이다.
현재 신테카바이오는 20,000여 개의 자체 R-그룹 라이브러리를 보유하고 있다. 슈뢰딩거에서 보고한 논문에 의하면 약물 핵심골격(Scaffold)에 R-그룹을 붙이는 시도를 단백질 바깥에서 수행하고 포켓 안으로 가지고 오는 반면 신테카바이오는 포켓에서 바로 2만여 개의 R-그룹 중에 활성이 높은 구조들을 바인딩 에너지 관점으로 자동으로 비교하고 선택하기 때문에 정량적구조활성관계(QSAR) 약효구조분석 방법이 더는 필요 없다. 그래서 신테카바이오의 약물 최적화는 자동 선도물질 최적화(Auto-Lead-optimization)이라고 부르고 있다. 현재 로컬 환경에서는 반자동으로 운영되지만 2023년 2분기 안에 STB CLOUD에 탑재하는 것을 목표로 하고 있다.
딥매쳐 플랫폼은 백신 및 항체 신약 영역에도
활용 가능한지.
신테카바이오의 딥매쳐는 포켓 안에 모든 잔기(residue)에 대해
레지스트리(registry) 정보를 출력으로 제공한다. 따라서
최종 바인딩 에너지 계산 시 포켓안에서 바인딩에 관여하는 핵심 잔기들의 분석 정보를 얻을 수 있다. 이러한
특징 덕분에 합성신약(단백질-리간드), 백신신약(MHC-펩타이드), 항체신약(항원-항체 CDR) 간의
상호작용에 대한 레지스트리 정보를 모두 계산할 수 있다.
자사의 AI-합성신약 플랫폼인 딥매쳐는 완전한 실용화 단계에 도달했다. 그리고 NEO-ARS™(AI-백신신약)는 검증 단계, AB-scan(AI-항체신약)은 개발 단계에 있다. 딥매쳐의 AI-합성신약은 후보물질 검색, 최적포즈 생성, 분자동역학
검증 단계까지 3가지 단계를 가지고 있다. 이 중 두 번째와
세 번째 단계는 백신신약 및 항체신약 계산에 그대로 사용할 수 있어 AI-백신 및 항체 신약 플랫폼
개발 기간이 단축될 수 있다고 보고 있다.
시장관점에서 봤을 때 NEO-ARS™가 발굴할 수 있는 신생항원은
세포치료제의 면역활성화에 핵심적 역할을 할 수 있고, 세포치료제 시장이 점차 커지고 있다는 점에서 의미가
크다고 할 수 있다. 또한 AB-scan(AI-항체신약)의 경우 플랫폼이 상용화되면 항체신약 시장 및 세포치료제 시장 성장과 맞물려 신약 개발에 큰 기여를 할 수 있을
것으로 기대하고 있다.
딥매쳐 플랫폼의 경쟁력과 가능성은.
현재 신테카바이오의 딥매쳐는 STB CLOUD에서 △후보물질 검색 △최적포즈 생성 △분자동역학
검증 단계까지 총 3단계가 3주 동안 200대의 CPU/GPU 서버에서 무중단으로 진행된다. 첫 번째 단계에서 10억 개의 화합물에서 물리화학적 성질 및 3차원(topology) 기반으로 1백만 개 물질을 선별하고 빠른 도킹 알고리듬으로 물리적 도킹을 통해서 더 깊은 단계로 들어가 최종 분자동역학 검증 단계까지 진행한다.
또한 딥매쳐 성능 개선을 위해 후보물질 검색단계에 요즘 화두가 되고 있는 GPT 도입을 고려하고 있다. 신테카바이오의 AI 플랫폼은
단백질 포켓 안에서 모든 잔기들의 레지스트리 정보 기반으로 움직이며, 이러한 레지스트리들은 언어 모델로
표현할 수 있기에 GPT를 이용한 POC(proof of
concept)를 시도하고 있다.
그 이외 나머지 두 단계도 이미 실용화된 상황이기 때문에 최신 하드웨어에 맞게 속도 및 성능이 계속 향상될 것으로
기대한다. 첫 번째, 두 번째 및 세 번째 단계가 모두 이렇게
혁신 IT기술과 연결되면 더 이상 경쟁자가 없는 거대 글로벌 Hit-발굴, 최적화 CRO로 거듭날 수 있을 것으로 본다.
△정종선 신테카바이오 기술총괄·대표이사










