AI 신약 파이프라인 개발 방식의 특징은 표준화(standardization) 및 확장성(scalability), 글로벌 CRO(임상시험수탁기관, Contract Research Organization) 기반 검증이다. 단백질 표적들의 특수성 및 다양성 등의 이유로 오랫동안 전통적 신약개발에서는 표준화가 거의 불가능했다. 그러나 IT의 발전으로 컴퓨터 성능(슈퍼컴퓨팅), 이종 컴퓨터들에 대한 통합 운영(클라우드) 등에 힘입어 표준화 그리고 확장이 가능해졌고, 불특정 다수의 타깃에 대한 신속한 약물 발굴도 가능해졌다.
완전자동화(fully-automated) 환경을 ‘원클릭’이라고 정의하면, 첫 번째 클릭으로 유효물질 발굴 및 글로벌 CRO 검증, 두 번째 클릭으로 약효 최적화 및 글로벌 CRO 검증, 그리고 세 번째 클릭으로 ADME-TOX 스크리닝 및 글로벌 CRO 검증 등이 가능하다. 즉, AI 신약 파이프라인의 진행 단계에 맞춰 일관성 있는 사업이 가능한 것이다.
현재 기술은 첫 번째 및 두 번째 클릭까지 가능함이 확인됐고, 세 번째 클릭 영역은 가능성은 확인했으며, POC(Proof of concept) 연구를 진행하고 있다. 현재 AI신약개발 선두 업체로서 신테카바이오는 전통 신약개발 방식과 차별화된 방식으로 다양한 AI 신약 파이프라인 프로젝트를 추진하고 있다.
AI 신약개발 방식의 특징.
AI 신약개발은 다양한 목적의 대상 리스트 발굴, 대규모 계산(computation)을 이용한 동시 진행 등으로 요약될 수 있다. 탐색 범위가 제한적인 전통 방식과 달리 수억~수십억 종의 대규모 화합물을 대상으로 활성물질 탐색이 가능하다. 또한 전문가의 직관으로 시행착오를 겪으며 개발하는 방식이 아니라 물리화학적 이론에 기초하고 있어 화합물과 단백질의 작용 기전을 명확하게 파악할 수 있다.
무엇보다 AI 신약 플랫폼으로 원하는 타깃을 원하는 만큼 시뮬레이션해 볼 수 있다는 장점이 있다. 이 과정에서 필요한 투자는 슈퍼컴 가동을 위한 전기요금 정도밖에 없다.
유연한 프로젝트 진행이 가능하다는 점도 AI 신약개발의 특징이다. 로직과 알고리듬 고도화 전에는 유효물질 발굴이 어려웠거나 개발 난도가 높았던 프로젝트라 할지라도 AI 알고리듬의 발전과 함께 충분히 유효물질, 선도물질 도출이 가능할 수 있다.
AI 신약개발이 전통 신약개발 방식과 다르게 프로젝트 유지에 별도의 비용이 들지 않기 때문에 가능한 일이다. 현재 알고리듬이 충분히 고도화된 만큼 신테카바이오는 타 기관에서 실패한 신약 프로젝트도 수집을 검토 중이다.
또한 컴퓨팅 파워만 충분히 보유하고 있다면 하나의 알고리듬으로 다수의 프로젝트를 동시에 수행하는 것도 가능하다. 팀 단위로 운영되는 전통 방식에서는 팀당 진행할 수 있는 신약 프로젝트가 제한적이고 비용 또한 만만치 않다. 하지만 AI 신약개발에서는 신테카바이오 내의 기술을 활용하고 보유하고 있는 컴퓨팅 파워를 이용해 수십 개의 프로젝트를 동시에 진행할 수 있다. 이후 AI로 예측된 후보 검증 시에는 공신력이 확인된 글로벌 CRO를 통해 합성 및 실험을 진행할 수 있어 빠르고 효율적인 검증이 가능하다.
△자료=신테카바이오 제공
신테카바이오의 신약개발 대상은.
AI 신약 프로젝트 진행 시 대상 단백질과 화합물의 결합 구조 정보가 필수적이다. 단백질 구조는 엑스선 결정학이나 극저온 현미경 등을 활용해 파악하는데, 비용과 시간이 많이 소요되는 고난도의 실험이기 때문에 인간 유전자의 약 30% 정도만 구조가 밝혀져 있었다.
다만 최근 딥마인드가 개발한 ’알파폴드2(AlphaFold2)’와 메타가 개발한 ‘ESM폴드(ESMFold)’의 공개로 3차원 구조의 확보가 용이해지면서 단백질 구조에 대한 제한은 많이 완화됐다. 하지만 아직도 단백질-화합물 간의 결합구조는 실험에 의존할 수밖에 없는 상황이며, 이 부문에서 딥매처(DeepMatcher®) 등 신테카바이오가 보유한 AI신약 플랫폼이 큰 역할을 수행할 수 있다.
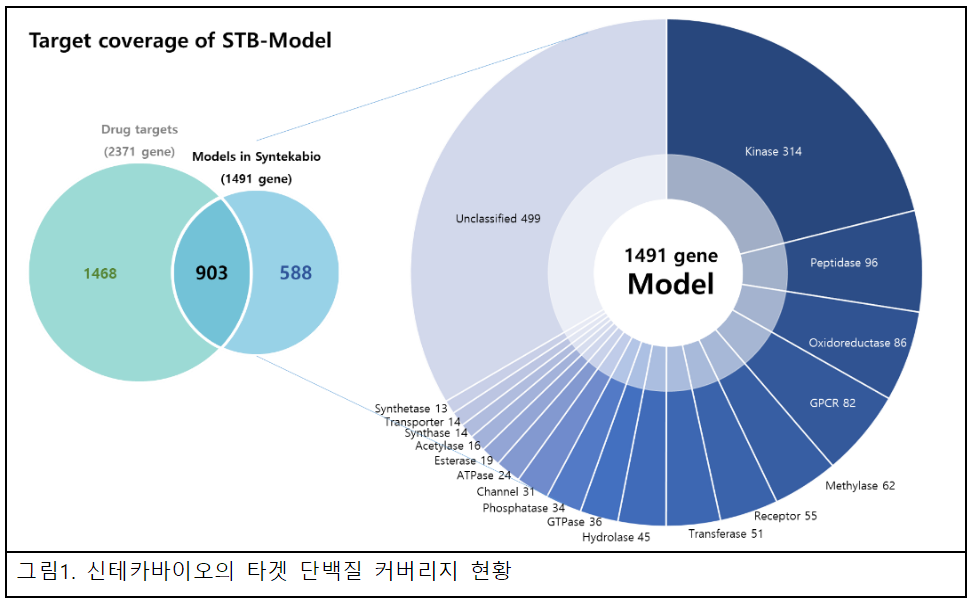
신테카바이오는 최근 1,491개 유전자에 대한 3,518개 모델 생성을 완료, 신약개발 진행을 준비하고 있다. 단백질-화합물 결합정보가 있는 대상을 모델화하는 것을 원칙으로, ‘Smart Template’이라는 자사 고유의 기술을 사용해 신약개발 적합성이 높은 모델을 구현하는 사전 작업을 완료했다.
대상 유전자들은 인간의 단백질 지도(Human Protein Atlas, 현존하는 인간 단백체 정보를 포괄하는 DB)에 질환과의 연관성이 확인된 유전자 및 Kinase, GPCR, Receptor Protein, Channel Protein 들이 포함돼 있어 다양한 대상에 대한 스크리닝이 가능하다.
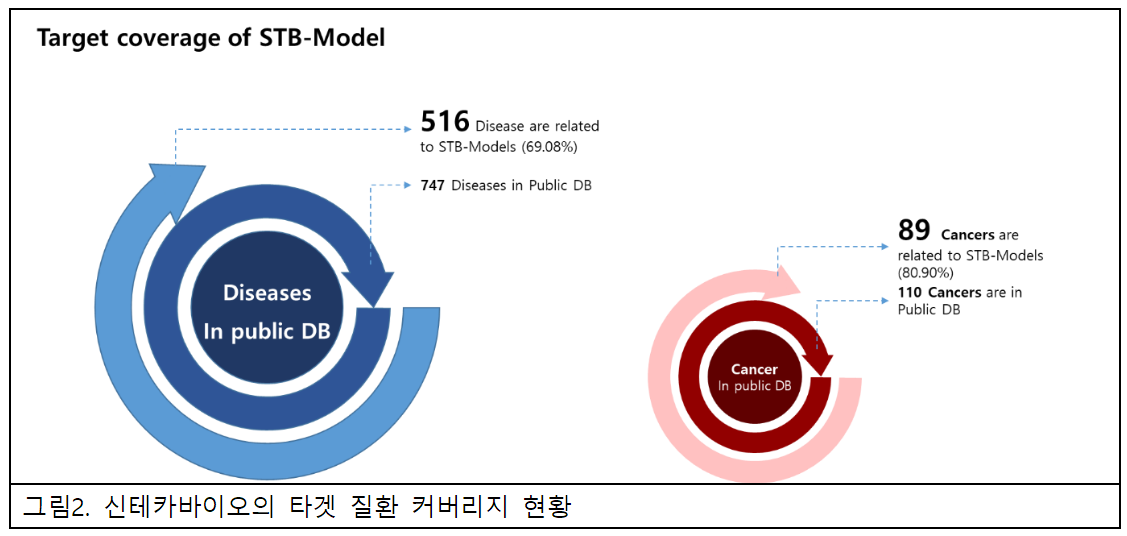
또한 해당 모델군을 타깃 질환 기준으로 볼 경우 유전자와의 관련성이 확인된 747개 질환 중 약 70%인 516개 질환과 연관돼 있으며, 세부적으로는 암 질환 110여종 중 89개에 대한 치료제 개발이 가능한 규모로 AI 신약개발에 적합한 대상을 모두 포함하고 있다.
약물재창출(DR) 프로젝트, 플랫폼 고도화와 후보물질 확보.
신테카바이오는 지난 2021년 하반기부터 대규모 ‘약물재창출’ 프로젝트를 진행해왔으며, 최근 biochemical assay를 통한 결과 검증을 완료했다. FDA 승인 약물을 포함하는 3,355개 물질을 당시 자사가 보유한 523개 3차원 단백질 모델에 적용하는 ‘all against all’ 방식으로 검증을 진행했으며, 검증 결과에서 내부 기준을 통과하는 437개 조합이 확인됐다.
이 중 58개 조합은 1uM 이하의 농도에서 50% 이상의 inhibition activity를 보였으며, 현재 유효성이 확인된 다수 약물을 대상으로 순차적으로 동물실험을 진행하고 있다. 또한 당시 프로젝트가 딥매처(DeepMatcher®) V1.5를 통해 진행된 만큼 성능이 크게 업그레이드된 V2.0에서 동일 프로젝트를 다시 진행할 경우 더 좋은 결과를 얻을 수 있을 것으로 예상된다.
이러한 대규모 발굴과 검증작업은 플랫폼 고도화와 후보물질 확보 측면에서 큰 의미가 있다. 프로젝트를 수행하며 신테카바이오는 AI 신약개발 방식의 가능성이 아닌 확신을 가질 수 있었으며, 대규모 검증데이터를 통해 AI 플랫폼인 딥매처(DeepMatcher®)의 고도화 과정에 활용할 우수한 데이터를 확보할 수 있었다.
또한 AI 신약개발은 단일 대상 단백질에 대한 스크리닝이 아닌 다수의 대상에 대한 다수 후보물질의 확보 및 이를 통한 약물 발굴 효율의 극대화에 그 목적이 있는데, DR프로젝트에서 AI 신약 발굴 프로젝트의 장점이 다시 한번 부각됐다고 판단된다.
Hit 기반 유도체 생성 및 약물 최적화, 신약개발 가속화의 핵심 과정.
신약개발은 유효물질 발굴과 이를 기반으로 한 선도물질 도출의 순서로 진행된다. 선도물질 도출은 활성 및 물성 개선, 독성 완화, 대사 정도 조절 등의 다수 약물 개발 조건에 부합되도록 개선하는 작업이며, 이는 유효물질 발굴 이상의 난이도를 가진다.
신약후보 물질 임상 실패의 가장 큰 원인으로 지적되는 것이 바로 ‘후보물질 최적화 미흡’이다. ‘최적화’는 임상 성공 확률을 높이고 신약개발 가속화 및 효율화를 위한 핵심 과정이며 신테카바이오는 이를 위한 플랫폼 준비 및 관련 내부 프로젝트를 진행하고 있다.
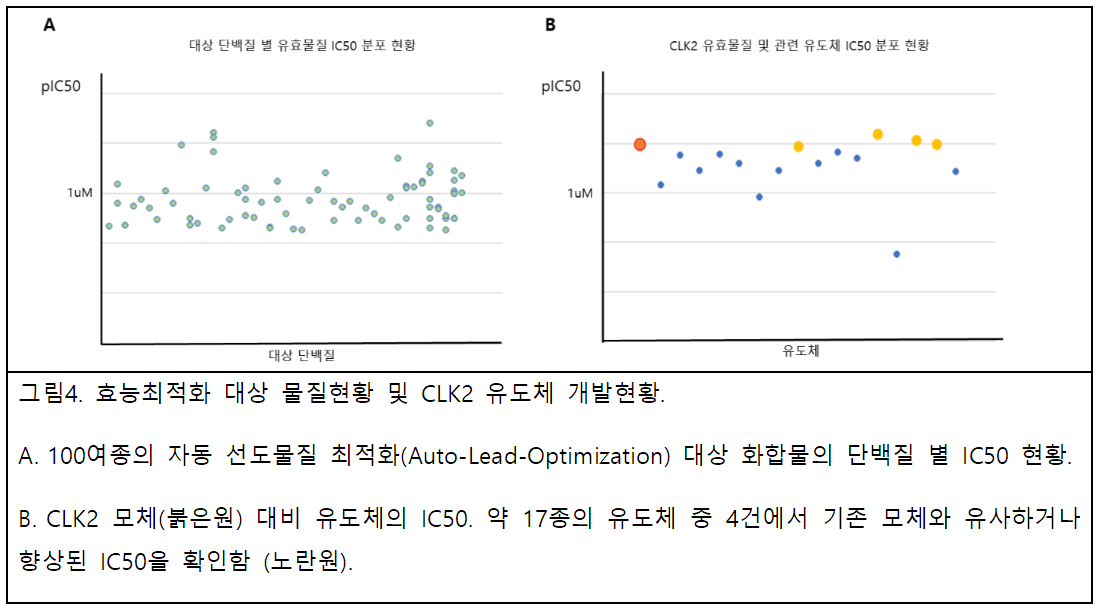
신테카바이오는 유효물질 확보 이후 결합력 향상을 통한 활성 개선 부분에 초점을 맞춘 ‘자동 선도물질 최적화(Auto-Lead-Optimization)’라는 AI 기반 자동 선도물질 최적화 플랫폼을 개발했다. 이를 이용해 지난 3년간 발굴된 100여종의 유효물질 후보에 대한 추가 스캐폴드(scaffold) 확보 및 활성 개선 연구를 진행하고 있다.
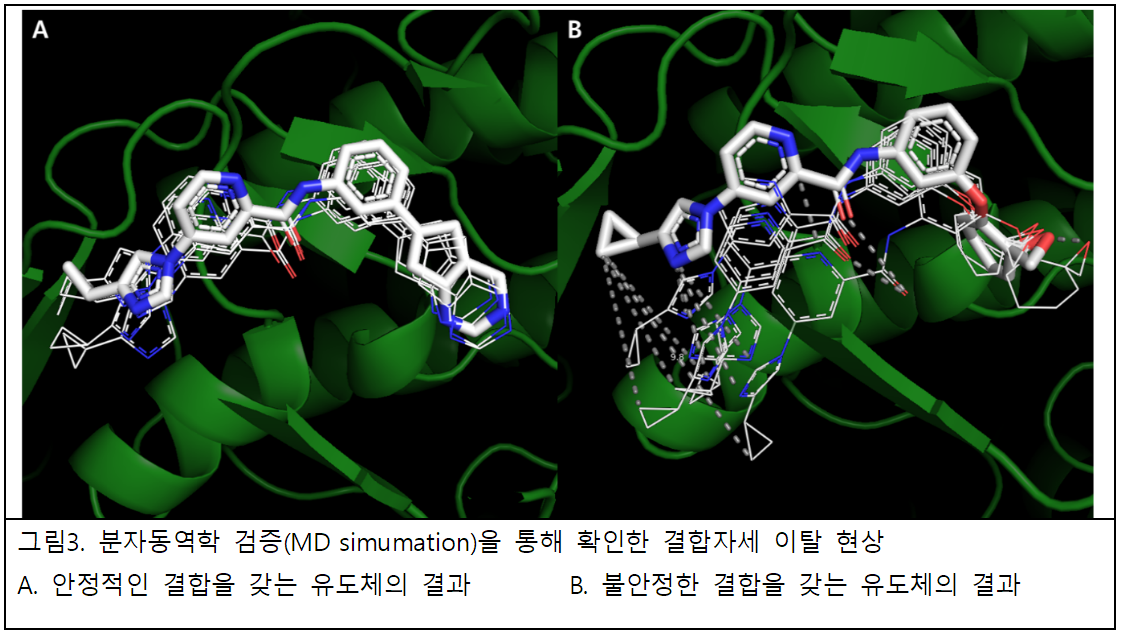
‘자동 선도물질 최적화(Auto-Lead-Optimization)’ 플랫폼은 스캐폴드를 고정한 상태로 자사가 보유한 20,000여종 이상의 R-group library를 사용, 추가 결합 형성을 목적으로 치환, 추가를 통해 유도체를 생성하는 ‘GAP2’ 알고리듬을 포함하고 있으며, 이후 분자동역학 검증(MD simulation)과 3차원 도킹(docking)을 통한 결합구조(binding mode) 예측 및 평가 과정을 거쳐 생성된 최적의 유도체를 제공한다.
신테카바이오는 약물 재창출을 통해 확보된 58종의 약물-대상 단백질 조합을 포함해 100여종의 유효물질들을 대상으로 약물
최적화를 진행 중이다. 최적화 대상으로 선별된 물질들은 대략 1.5nM~30uM의 IC50이 확인된 물질들이며 각 물질-대상 단백질별로 다양한 목적을 가지고 있다.
예를 들어 IC50값이 낮은, 결합력이
좋은 물질들의 경우에는 후보물질의 확장을 통한 파이프라인 강화를 위해 유도체 선별을 진행하거나 특허의 신규성 확보를 위한 목적으로 사용된다. 또 결합력이 낮은 물질들의 경우 유도체 생성을 통해 기존 물질의 신규성을 확보한 상태에서 결합력을 향상시키기
위한 목적으로 적용되기도 한다.
이러한 다양한 접근을 통해 유효물질의 효능 구간별 플랫폼의 성능을 확인하고 이를 통한 선도물질 최적화(Lead-Optimization) 플랫폼 성능 강화를 위한 목적으로도 활용하고 있다. 특히 이 과정에서 MD simulation을 통한 분석으로 위양성을
제거하는 자사 특유의 기술을 확보했다.
CLK2 억제제(inhibitor)의
경우를 예로 들면, 선도물질 최적화(Lead-Optimization) 플랫폼을 이용, 모체를 기반으로 억제 효능이 향상된 4종의
유도체를 추가해 파이프라인 물질을 다양화하고 있다.
신테카바이오가 그린 AI 신약개발의 미래.
신테카바이오가 진행 중인 AI 신약 파이프라인 및 프로젝트의 공통적인 특징은 AI 플랫폼을 활용한 대규모 검증 및 알고리듬 성능 개선, 다수의 유효물질 발굴 및 다수 프로젝트 동시 진행이다. 모든 프로젝트의 중심에 AI 및 알고리듬이 존재한다. 이는 분명 전통 신약개발 프로세스와 다르지만 효율적인 프로세스를 가지고 있음은 명백한 사실이다.
현재 전통 신약 업계는 극심한 R&D 효율 저하에 직면하고 있으며, 이를 극복하기 위한 수단으로 AI가 주목받고 있다. 최근 인실리코 메디슨(Insilico Medicine)사가 AI를 통해 개발한 신약후보물질인 ‘INS018_055’가 특발폐섬유증(IPF)을 적응증으로 FDA 희귀의약품으로 지정받는 등 업계 상황도 긍정적이다.
또한 알파폴드2와 ESM폴드를 이용해 다양한 구조정보를 높은 신뢰도로 확보할 수 있으며, 이제는 리간드(Ligand)와의 결합 정보가 없는 상태의 대상 단백질에 대해서도 신약개발이 가능해진 상황이다. AI신약개발의 장점인 ‘다수의 타깃 대상 다수의 후보물질 신속한 발굴’이 부각될 수 있는 환경이 조성됐다.
AI는 신약후보물질 발굴, 약물 구조설계뿐만 아니라 ADME-TOX 등 전임상 시험 자동화, 임상 설계 및 피험자 모집, 임상시험 최적화 등 신약개발 전 과정에서 다양하게 활용되고 있다.
AI가 기존 전통 신약개발 과정의 막대한 시간과 비용을 획기적으로 줄여주고 신약개발 성공률 상승에도 크게 기여하고 있다. 알고리듬의 발전과 함께 AI는 신약개발 전 주기에 걸쳐 더 많은 역할을 수행하게 될 것이다. 그리고 그 과정에 신테카바이오가 든든한 동반자가 될 것이다.

▲정종선 신테카바이오 대표









